Setelah diteliti oleh
para ahli terdahulu disimpulkan bahwa di dalam atom terdapat tiga partikel, yaitu
elekton yang bermuatan negatif yang mengelilingi inti
atom. proton yang bermuatan positif dan neutron yang tidak bermuatan atau netral.
Berdasarkan data di atas.
1. Hubungan proton dengan nomor atom
Proton ditentukan berdasarkan nomor atom
2. Hubungan neutron dengan nomor atom dan nomor massa
Untuk mencari neutron nomor massa dikurang dengan
nomor atom
3. Hubungan elektron dengan nomor atom
Elektron sama dengan nomor atom
Maka, dari data diatas dapat
disimpulkan bahwa pada atom netral, jumlah elektron dalam atom sama dengan jumlah protonnya. Dan
untuk menentukan neutron suatu atom adalah dengan mengurangkan nomor massa dan nomor atom
·
Isotop adalah atom-atom dari dari
unsur yang sama (mempunyai nomor atom sama), tetapi mempunyai nomor massa yang
berbeda.
·
Isobar adalah atom dari unsur yang
berbeda (nomor atom berbeda), tetapi mempunyai nomor massa yang sama.
·
Isoton adalah atom dari unsur yang
mempunyai nomor atom dan nomor massa yang berbeda, tetapi mempunyai jumlah
neutron yang sama.
Elektron yang ada dalam kulit terluar disebut
elektron valensi. Susunan elektron dalam mengisi kulit atom disebut konfigurasi
elektron. Konfigurasi elektron digunakan untuk menentukan letak unsur dalam
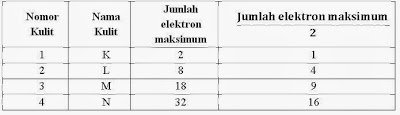
sistem periodik unsur. Jumlah maksimum elektron yang dapat
menempati satu kulit sesuai dengan rumus 2n2 (n = nomor kulit). Konfigurasi
elektron merupakan
susunan elektron pada setiap kulit atom. Kulit atom pertama diberi nama kulit K, kemudian kulit L,
kulit M, kulit N dst.Penyebaran elektron pada kulit atom dapat
dilihat pada gambar dibawah ini.
Hubungan antara “nomor kulit” dengan
“jumlah elektron maksimum : 2”
adalah
1=1
2=4
3=9
4=16
Didapatkan hubungannya yaitu setiap hasil
tersebut merupakan kuadrat atau pangkat dua dari angka 1,2,3 dan 4.
1=12=1
2=22=4
3=32=9
4=42=16
Cara menentukan elektron maksimum pada
setiap kulit (K, L, M,N) menurut tabel diatas :
Banyak elektron
maksimum pada setiap kulit :
kulit 1= 2 x1 = 2
kulit 2= 2 x 4= 8
kulit 3= 2 x 9 = 18
kulit 4= 2 x 16 = 32
Dimana nilai
1, 4, 9, 16 merupakan berturut-turut akar kuadrat dari 1, 2,
3, 4.
Dari data tersebut
dapat dirumuskan jumlah elektron terbanyak disetiap kulit yaitu
2n2
keterangan
: n= letak kulit
Penentuan golongan suatu unsur pada sistem
periodik unsur ditentukan dari jumlah elektron valensi/kulit terluar dari suatu
unsur. Sedangkan penentuan periode, ditentukan dari jumlah kulit terluar dari
suatu unsur. Periode dituliskan dengan angka sedangkan golongan biasanya
dituliskan dengan huruf romawi diikuti dengan kode golongan. Pada tabel
periodik unsur, letak golongan yaitu dilihat secara vertikal, sedangkan letak
periode dilihat secara horisontal.
Contoh :
Catatan :
untuk menentukan golongan suatu unsur pada sistem periodik
unsur adalah dapat dilihat dari elektron valensi atau jumlah elektron
terluarnya.
Untuk
menentukan periode dapat dilihat dari jumlah kulit dari atom tersebut.
Tentukan
golongan serta periode dari atom-atom berikut.
1. 6C
konfigurasi elektron : 7C : 2 4
elektron valensi = golongan = IV A
jumlah kulit = periode = 2
2.
7X
konfigurasi elektron : 7X : 2 5
elektron valensi = golongan = V A
jumlah kulit = periode = 2
3. 13D
konfigurasi elektron : 7D : 2 8 3
elektron valensi = golongan = III A
jumlah kulit = periode = 3
4.
15Y
konfigurasi elektron 15Y : 2 8 5
elektron valensi = golongan = VA
jumlah kulit = periode = 3
5. 18M
konfigurasi elektron 18Y : 2 8 8
elektron valensi = golongan = VIII A
jumlah kulit = periode = 3
6.
20Z
konfigurasi elektron 20Z : 2 8 8 2
elektron valensi = golongan = II A
jumlah kulit = periode =
4
Letak unsur pada soal diatas apabila diletakkan
pada Sistem Periodik Unsur berikut :




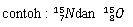




Tidak ada komentar:
Posting Komentar