HANDOUT SISWA
Bilangan
oksidasi (biloks) adalah angka atau bilangan yang menyatakan banyaknya elektron yang telah dilepaskan atau diterima oleh suatu atom dalam suatu senyawa.
Tabel bilangan
oksidasi unsur, molekul, dan ion.
No.
|
Jenis zat
|
Biloks
|
Contoh
|
Keterangan
|
1
|
Unsur bebas
|
0
|
H, N, S, Ca, Cu, Ag
|
|
2
|
Molekul bebas
|
0
|
H2, N2, O2,
Cl2, Br2
|
|
3
|
Hidrogen (H)
|
+1
-1
|
H dalam HCl, H2O
H dalam senyawa hidrida, misalnya
NaH, BaH2
|
Biloks umum untuk H=1
|
4
|
Oksigen (O)
|
-2
-1
+2
|
O dalam CO2
O dalam senyawa peroksida, misalnya H2O2.
BaO2
O dalam OF2
|
Biloks umum untuk O = -2
|
5
|
Ion tunggal
|
Sesuai muatannya
|
K+ = +1
Al3+= +3
Fe+2= +2
Fe+3= +3
|
Biloks sesuai dengan muatannya.
|
6
|
Sesuai muatannya
|
SO4-2 = -2
NH4+ = +1
PO4-3 = -3
NO3-1=
-1
OH-
= -1
|
||
7
|
Berdasarkan golongan
|
Gol IA= +1
Gol IIA=+2
Gol IIIA=+3
Gol IVA=+4
Gol VA= -3
Gol VIA= -2
Gol VIIA = -1
|
H, Li, Na, K, Rb, Cs, Fr dalam senyawanya.
Be, Mg, Ca, Sr, Ba, Ra dalam
senyawanya.
B, Al, Ga, In, Ti dalam senyawanya.
C, Si, Ge, Sn, Pb dalam senyawanya.
N, P, As, Sb, Bi dalam senyawanya.
O, S, Se, Te, Po dalam senyawanya.
F, Cl, Br, I, At dalam senyawanya.
|
Ada unsur yang memiliki lebih dari
satu biloks, tergantung senyawanya.
|
8
|
Senyawa
|
0
|
HCl, CH3COOH, Ca(OH)2
|
Jumlah muatan (+) sama dengan jumlah
muatan
|
Cara
menentukan bilangan oksidasi(biloks) suatu unsur adalah sebagai berikut :
Contoh :
1. Bilangan oksidasi Cl
dalam senyawa HCl
Jawab :
Biloks senyawa HCl = 0
Senyawa HCl terdiri atas 1
unsur H dan 1 unsur Cl
Biloks HCl = biloks H +
biloks Cl
0 = +1
+ biloks Cl
0 - 1
= Biloks Cl
-1 =
Biloks Cl
2. Bilangan
oksidasi Cr dalam senyawa Cr2O72-
jawab :
Bilangan oksidasi senyawa Cr2O7
= -2
Senyawa Cr2O7
terdiri atas 2 unsur Cr dan 7 unsur O
Biloks Cr2O7 = 2 Biloks Cr + 7 biloks O
-2 =
2 biloks Cr + 7(-2)
-2 =
2 biloks Cr -14
-2 + 14 = 2 biloks Cr
+ 12 =
2 biloks Cr
+12 : 2 =
biloks Cr
+6 = biloks Cr
Reaksi redoks sebagai penggabungan dan pelepasan
oksigen.
Oksidasi
yaitu proses pengikatan oksigen.
Contoh:
Reduksi yaitu proses
pelepasan gas oksigen.
Contoh :
Reaksi Redoks sebagai penerimaan dan pelepasan
elektron
Reaksi oksidasi adalah peristiwa
pelepasan elektron, dimana suatu zat memberikan elektron kepada lainnya.
Sedangkan reaksi reduksi adalah
peristiwa penangkapan elektron, dimana suatu zat menerima elektron dari zat
lain.
Reaksi Redoks sebagai peningkatan dan penurunan bilangan oksidasi
Reaksi
reduksi adalah peristiwa penurunan bilangan oksidasi, sedangkan oksidasi adalah
peristiwa yang mengalami kenaikan bilangan oksidasi.
Reduksi : O karena mengalami reaksi
penurunan bilangan oksidasi dari 0 menjadi -2
Oksidasi : Ca karena mengalami peningkatan bilangan
oksidasi dari 0 menjadi +2
Bilangan oksidasi Ca = 0
Bilangan oksidasi O2 = 0
Bilangan oksidasi pada senyawa CaO:
Ca = +2
O =
-2
Reduktor dan Oksidator
|
Reduktor (pereduksi) = zat yang mengalami oksidasi (bilangan oksidasinya
naik)
Oksidator (pengoksidasi) = zat yang mengalami reduksi(bilangan
oksidasinya turun)
|




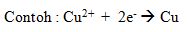

Tidak ada komentar:
Posting Komentar